La matière peut se trouver à l'état solide, liquide ou gazeuse.
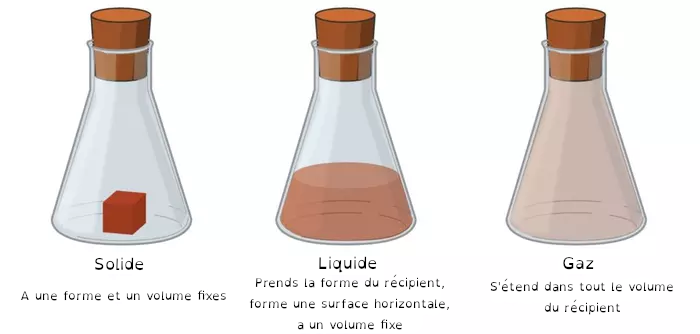
A l'échelle des particules qui constituent la matière (atomes et molécules, nous y reviendrons), tout est une question de température (et de pression) :
- à l'état solide, état condensé (les particules sont très proches les unes des autres), elles ne peuvent se déplacer, un solide garde sa forme. Lorsqu'on chauffe de la matière, ses particules s'agitent de plus en plus. Pour les espèces chimiques qui ne brûlent pas (cas des matériaux organiques, nous y reviendrons aussi), elles se mettent à glisser les unes sur les autres, c'est le passage à l'état liquide (fusion).
- si on continu à chauffer ce liquide (état encore condensé), les particules s'agitent tellement qu'elles finissent par se disperser dans tout l'espace disponible, c'est le passage à l'état gazeux (état dispersé).
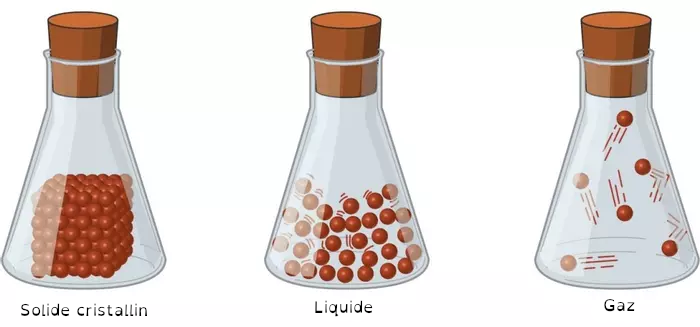
Sur cette image on parle d'un solide cristallin : vous pouvez voir ici que les particules semblent "bien rangées", c'est le cas pour les cristaux et les métaux mais pour d'autres solides, dits "amorphes", ces particules peuvent être entassées de façon désordonnée.
Noms des changements d'états
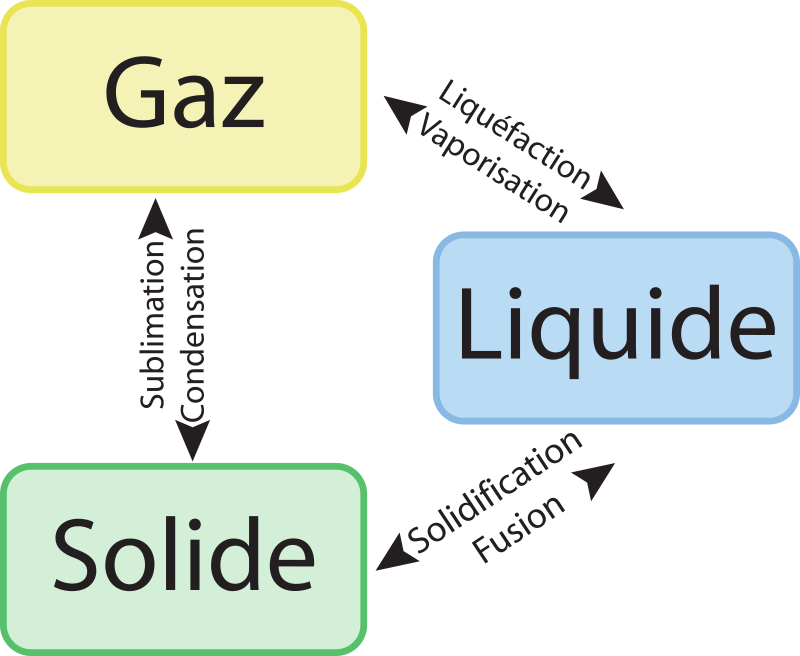
Remarque : le passage de liquide à gaz est appelé liquéfaction notamment lorsque le gaz est comprimé pour passer à l'état liquide, lorsque ce passage est du à un abaissement de température, on parle aussi de condensation.
Remarque : notion de "zéro absolu"
Il n'y a pas de limite supérieure à la température tant que des particules pourront s'agiter davantage. Mais si on fait le cheminement inverse, il y a une limite au refroidissement : lorsqu'on refroidi un solide, ses particules s'agiteront de moins en moins jusqu'à ce qu'elles ne s'agitent plus du tout. On ne peut alors refroidir davantage, on a atteint la température la plus froide de l'Univers appelée "zéro absolu". Cette température est connue, c'est l'origine de l'échelle de température utilisée par les scientifiques dont l'unité est le degré Kelvin, 0 °K = - 273,15 °C.
