 En 1897, Joseph John Thomson (physicien britannique) découvre l'électron, particule de charge électrique négative contenue dans l'atome. C'est une révolution ! L'atome qu'on croyait jusque là incassable était lui même constitué de particules plus petites !
En 1897, Joseph John Thomson (physicien britannique) découvre l'électron, particule de charge électrique négative contenue dans l'atome. C'est une révolution ! L'atome qu'on croyait jusque là incassable était lui même constitué de particules plus petites !

Il imagine l'atome comme une sphère remplie d'une substance électriquement positive et fourrée d'électrons négatifs "comme des raisins dans un cake".
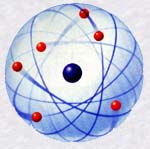
Ce qui retient les électrons autour du noyau n'est pas une force due à la gravitation mais une force électromagnétique. En effet, le noyau et les électrons portent des charges électrostatiques : le noyau est constitué de protons qui portent des charges positives, les électrons portent chacun une charge négative. En électrostatique, les charges de même signe se repoussent alors que les charges de signe contraire s'attirent, comme des aimants. Ainsi, le noyau attire les électrons qui se mettent à "tourner" autour de lui.
Un atome étant toujours neutre, il contient autant d'électrons (négatifs) que son noyau contient de protons (positifs).
Les recherche effectuées dans les années 1930 par James Chadwick (assistant de E. rutherford), Irène et Frédéric Joliot-Curie, Werner Heisenberg, Enrico Fermi et bien d'autres permirent de découvrir que le noyau ne contenait pas que des protons mais aussi des neutrons, particules de masse équivalente au proton mais neutres. Ces neutrons participent à la cohésion du noyau dont les protons, de même charge, se repoussent.
- Le noyau d'hydrogène, plus petit des atomes, ne contient qu'un proton. (il n'a pas besoin de neutron...)
- Le noyau de l'hélium contient deux protons et deux neutrons.
- La proportion de neutrons dans le noyau augmente avec la quantité de protons qu'il contient : de 1 neutron pour 1 protons pour les plus petits atomes, on passe à 1,5 neutron pour 1 proton pour les plus gros.
Protons et neutrons, constituants du noyau de l'atome sont appelés des nucléons.
En une quarantaine d'année, le modèle de l'atome est donc passé d'une bille pleine incassable à un modèle dit "lacunaire" : un noyau concentrant plus de 99,9 % de la masse de l'atome, autour duquel se distribuent des électrons pour former un nuage 100 000 fois plus étendu que le noyau lui-même (si on représente le noyau par une sphère d'un centimètre de diamètre, le nuage d'électrons s'étend jusqu'à un kilomètre...). Le volume d'un atome, représenté approximativement par une sphère, est donc essentiellement vide...
En vidéo (par le CEA - Commissariat à l'Energie Atomique)
(L'évocation des quarks est hors programme, vous en entendrez parler si vous poursuivez des études scientifiques ;)
Retour sur le symbole des atomes
Dans chaque case de la Classification Périodique des Eléments apparaissent des chiffres à côté du symbole de l'atome. Le plus élevé correspond au "Nombre de masse" (noté A) et correspond au nombres de nucléons (protons + neutrons) que contient le noyau. Le second correspond au "Numéro atomique" (noté Z) et correspond au nombre de charges (protons) du noyau (l'atome étant neutre, ce chiffre correspond également au nombre d'électrons).
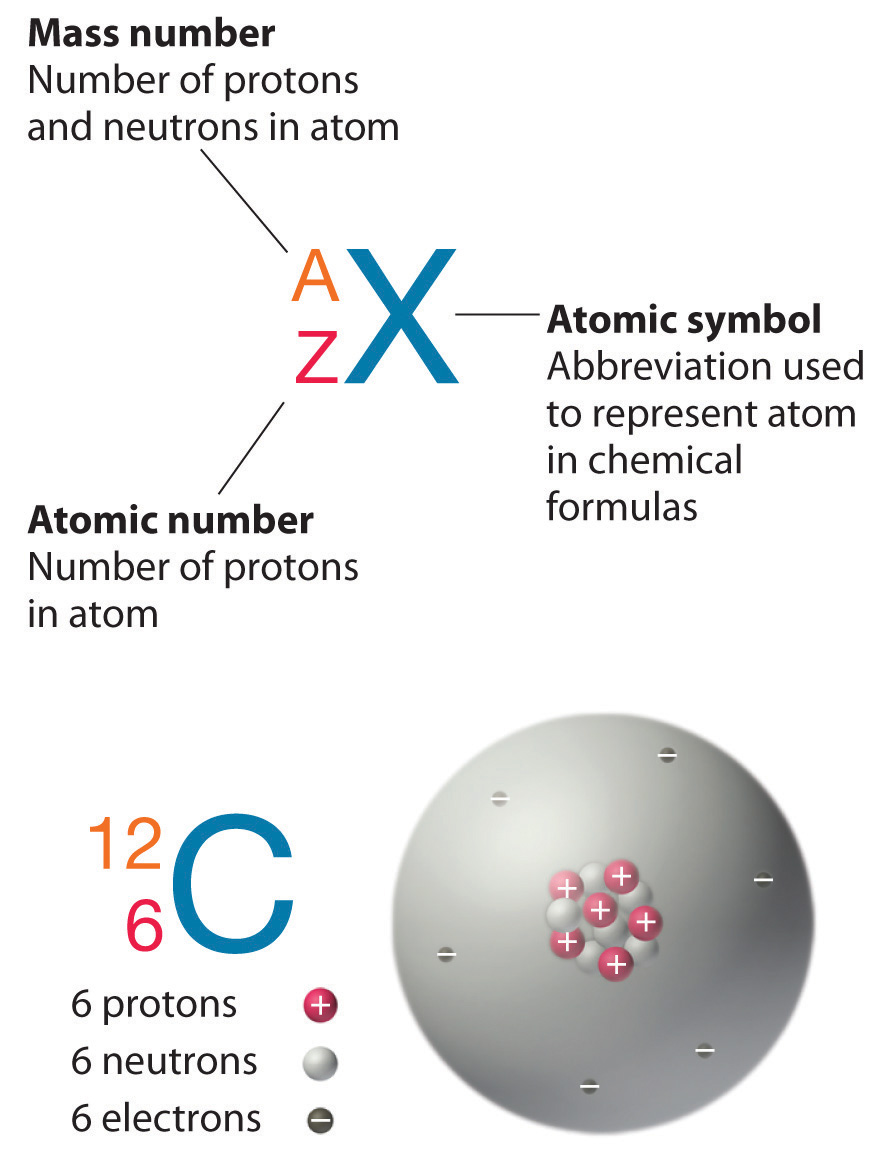
C'est pas sorcier : Voyage au coeur de la matière
(seule les 10 premières minutes de cette vidéo correspondent au cours de cycle 4,
vous pouvez toujours regarder la suite mais les notions abordées sont de niveau lycée voire au delà alors ne soyez pas surpris de ne pas tout comprendre ;)


