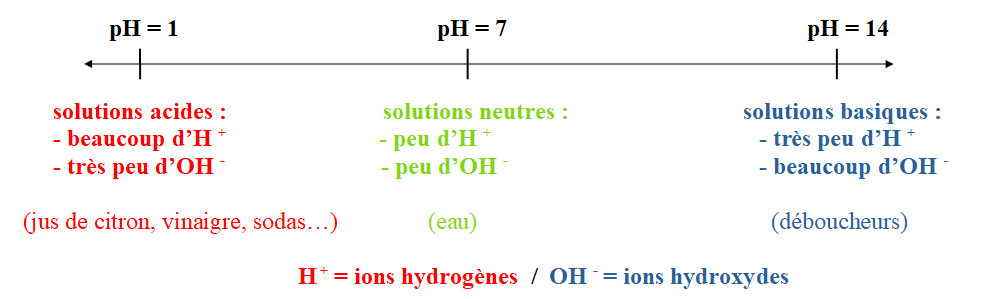
L'acidité d'une solution rend compte de sa concentration en ions hydrogènes (H+) : plus cette concentration est élevée, plus la solution est dite acide.
On mesure l'acidité d'une solution grâce à son potentiel hydrogène (pH). Ce pH est une grandeur sans unité qui varie de 1 à 14. Plus le pH est petit, plus la solution est acide, plus le pH est grand, plus la solution est basique, autour de 7 la solution est neutre.
Une solution basique contient des ions hydroxyde (OH -).
Les solutions acide et basiques sont corrosives.
En vidéo par Philippe Mancini, professeur (PeerTube Académique)
Une solution est électriquement neutre. Donc, si elle contient des ions hydrogènes (positifs), elle contiendra aussi des anions (négatifs). Selon la sorte d'anions présents, on obtient différents acides :
Acide chlorhydrique : H+ + Cℓ- (l'ion négatif présent est l'ion chlorure : Cℓ-)
Acide sulfurique : 2H+ + SO42- (l'ion négatif présent est l'ion sulfate : SO42-)
(pour cet acide il faut ajuster sa formule afin que la solution reste neutre. Il faut donc deux ions hydrogène pour un ion sulfate)
Une solution basique : l'hydroxyde de sodium (soude) : Na+ + OH-
Remarques : "Neutralisation d’un acide par une base - Equilibre de l'eau"
On peut neutraliser un acide (ions hydrogène) en le mélangeant avec une solution basique (ions hydroxyde) : les ions hydrogène et les ions hydroxyde réagissent entre eux pour former de l’eau.
H+ + OH- = H2O
Cette réaction est réversible (elle se passe dans les deux sens) : en permanence dans l'eau quelques molécules d'eau se séparent pour former des ions hydrogène et hydroxyde alors qu'ailleurs dans la solution des ions hydrogène et hydroxyde s'associent pour former des molécules d'eau. L'acidité d'une solution est une question d'équilibre entre ces deux là...
