La plupart des métaux subissent la corrosion : au contact de l'air apparaît une couche différente à leur surface.
Ce phénomène est du à une réaction chimique avec un des gaz de l'air.
Vidéo de la chaine Youtube "Dialogue de sciences physiques"
Composition de l'air
 |
L'air est un mélange de gaz constitué majoritairement de diazote (N2, environ 80%) et de dioxygène (O2, environ 20%). On trouve des traces de nombreux autres gaz (vapeur d'eau (H2O) dioxyde de carbone (CO2) entre autre) mais qui ne représentent guère plus de 1% de ce mélange. |
Pour savoir quel gaz de l'air réagit avec un métal lors de la corrosion, on peut réaliser l'expérience schématisée ci-dessous :
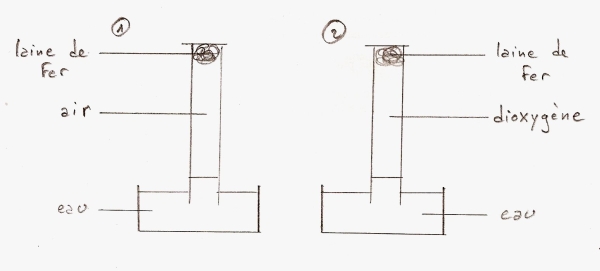
- Si la corrosion est une réaction avec le diazote, le volume de gaz contenu dans l'éprouvette du montage n°1 devrait diminuer de 80% alors que celui de l'éprouvette du montage n°2 ne devrait pas bouger.
- Si la corrosion est une réaction avec le dioxygène, le volume de gaz contenu dans l'éprouvette du montage n°1 devrait diminuer de 20%, celui de l'éprouvette du montage n°2 devrait être totalement absorbé par la réaction.
Activité
A l'aide des documents suivants, tracer un graphique représentant l'évolution du volume de gaz dans chacune des éprouvettes en fonction du temps. (tracer les deux courbes (dans l'air, dans le dioxygène) sur le même repère)
- Consignes pour le traçage d'un graphique
- Chronophotographie de l'expérience + papier millimétré (à partir des dates et heures auxquelles ont été prises les photos, calculer le temps (en heures) écoulé depuis le début de l'expérience) (télécharger le document si les images ne s'affichent pas correctement)
Suite à cette expérience, on peut affirmer que c'est la seconde hypothèse qui est vérifiée : le dioxygène est le gaz qui réagit avec le fer pour former la rouille (appelée "Oxyde de fer"). On peut alors rendre compte de cette réaction par son équation de réaction :
fer + dioxygène -> oxyde de fer III (= rouille)
Cette réaction est appelée une oxydation.
Remarque
Le fer étant le métal le plus répandu sur Terre, c'est aussi le plus fréquemment utilisé. Il existe différentes façons de le protéger :
- On peut le recouvrir d'une peinture étanche (peinture anti-corrosion au minium de plomb). C'est la méthode la moins coûteuse et la plus répandue.
- On peut le recouvrir d'une couche d'un autre métal comme l'étain (fer blanc des boites de conserve) ou le zinc (fer galvanisé). Cela se fait par dépôt électrolytique, cette méthode est plus coûteuse que la précédente.
- L'utilisation de l'acier inoxydable est la seule méthode qui soit définitive : la peinture ou la couche de métal ne sont plus efficaces si leur surface est percée (rayure, coup…). L'"inox" est un alliage constitué de 72% d'acier (fer contenant moins de 1% de carbone), 18% de chrome et 10% de nickel. C'est la méthode la plus chère des trois car le chrome et le nickel sont des métaux bien plus précieux que le fer.

![[Reproduction et partage sans but commercial] on https://about.gitlab.com/images/blogimages/rust.jpg&q=0&b=1&p=0&a=0 Rouile](https://s1.qwant.com/thumbr/700x0/8/e/ab5b86edd23f67e6e7433a6a07458ae521424d5e8934240b7e00f00991e69c/rust.jpg?u=https://about.gitlab.com/images/blogimages/rust.jpg&q=0&b=1&p=0&a=0)

![By George Hodan [Public Domain] on www.publicdomainpictures.net statue of liberty w](/jphy/images/images/chimie/corrosion/statue-of-liberty-w.jpg)
,_numéro_1,_toit.jpg/512px-Boulevard_Saint-Michel_(Paris),_numéro_1,_toit.jpg)
![[Public Domain] from pxhere.com investir-dans-l-or](https://c.pxhere.com/photos/63/03/gold_bullion_ing_gold_bullion_bar_of_gold_gold_bar_rich_money-1342490.jpg!d)
![[Public Domain] from pxhere.com peindre-sur-du-chrome](https://c.pxhere.com/photos/ac/bd/harley_davidson_motorcycle_engine_transportation_vehicle_chrome-1126896.jpg!d)