- Détails
- Écrit par F Leleu
Deux liquides qui se mélangent bien sont miscibles. S'ils ne se mélangent pas, ils sont non-miscibles.
Lorsqu'un mélange présente partout le même aspect, il est homogène. Si on distingue des choses différentes (particules solides, gaz ou plusieurs phases), on dit que ce mélange est hétérogène.
Un liquide dans lequel ont peut dissoudre des solides est un solvant. le solide qu'on dissout est le soluté, le liquide obtenu s'appelle une solution.
soluté + solvant -> solution
sel + eau -> solution de sel dans l'eau
Méthodes de séparation :
Lorsqu'on a un mélange hétérogène, il y a plusieurs méthodes pour obtenir un liquide homogène comme :
- la décantation :
On peut séparer certains constituants d’un liquide hétérogène en le laissant reposer dans un récipient. S’il contient des particules solides, lourdes, elles vont se déposer au fond du récipient (ex : pulpe d’un jus d’orange ). Si ce liquide est un mélange de deux produits non miscibles, ils vont se séparer (ex : vinaigrette ). Si ce liquide contient un gaz, ce dernier va s’échapper (ex : eau gazeuse éventée ). Pour les deux premiers cas, on récupérera le liquide décanté en le transférant doucement dans un autre récipient.
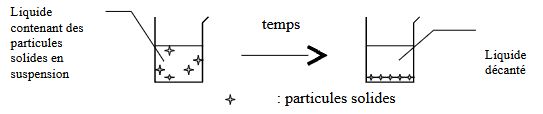
Remarque : cette méthode est efficace mais peut être très longue. Elle peut être accélérée par une centrifugation, ce qui augmente son coût.
- la filtration :
On fait passer un liquide contenant des particules solides à travers un filtre. Toutes les particules de taille supérieure à la taille des trous restent dans le filtre. Le liquide homogène obtenu est appelé le filtrat.
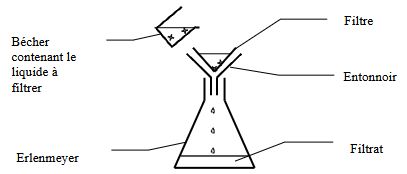
Remarque : cette méthode est plus rapide que la première mais elle est plus contraignante. Il faut changer ou nettoyer le filtre régulièrement. (Certains filtres de haute précision coûtent très cher !)
- Détails
- Écrit par F Leleu
Deux liquides qui se mélangent bien sont miscibles. S'ils ne se mélangent pas, ils sont non-miscibles.
Lorsqu'un mélange présente partout le même aspect, il est homogène. Si on distingue des choses différentes (particules solides, gaz ou plusieurs phases), on dit que ce mélange est hétérogène.
Un liquide dans lequel ont peut dissoudre des solides est un solvant. le solide qu'on dissout est le soluté, le liquide obtenu s'appelle une solution.
soluté + solvant -> solution
sel + eau -> solution de sel dans l'eau
Méthodes de séparation :
Lorsqu'on a un mélange hétérogène, il y a plusieurs méthodes pour obtenir un liquide homogène comme :
- la décantation : on laisse reposer le liquidide jusqu'à ce que les particules "lourdes" coulent au fond et que le plus légères remontent à la surface. Cette méthode n'est pas chère mais elle peut prendre beaucoup de temps.
- la filtration : on fait passer le liquide au travers d'un filtre, les particules plus grosses que les trous du filtre restent coincées dedans. Le liquide obtenu s'appelle le filtrat.
- Détails
- Écrit par F Leleu
Un voyage de l'infiniment grand à l'infiniment petit et vice versa.
(proposé par "Connected by nature")
- Détails
- Écrit par F Leleu
La matière peut se trouver à l'état solide, liquide ou gazeuse.
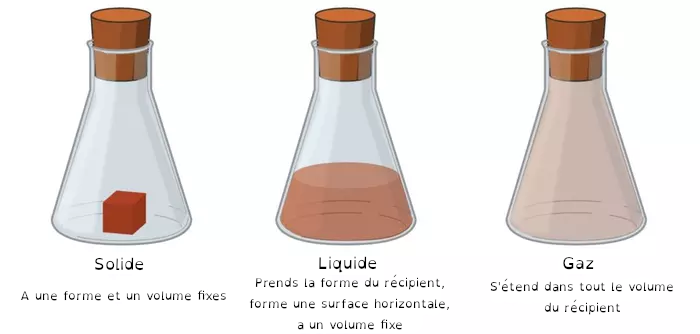
A l'échelle des particules qui constituent la matière (atomes et molécules, nous y reviendrons), tout est une question de température (et de pression) :
- à l'état solide, état condensé (les particules sont très proches les unes des autres), elles ne peuvent se déplacer, un solide garde sa forme. Lorsqu'on chauffe de la matière, ses particules s'agitent de plus en plus. Pour les espèces chimiques qui ne brûlent pas (cas des matériaux organiques, nous y reviendrons aussi), elles se mettent à glisser les unes sur les autres, c'est le passage à l'état liquide (fusion).
- si on continu à chauffer ce liquide (état encore condensé), les particules s'agitent tellement qu'elles finissent par se disperser dans tout l'espace disponible, c'est le passage à l'état gazeux (état dispersé).
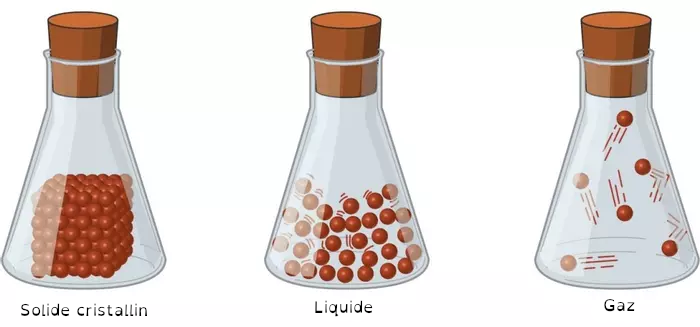
Sur cette image on parle d'un solide cristallin : vous pouvez voir ici que les particules semblent "bien rangées", c'est le cas pour les cristaux et les métaux mais pour d'autres solides, dits "amorphes", ces particules peuvent être entassées de façon désordonnée.
Noms des changements d'états
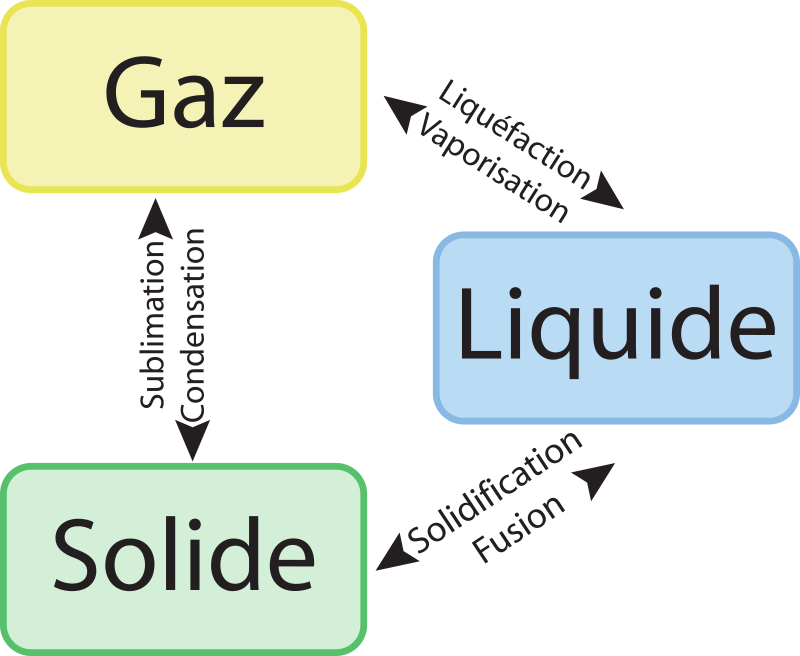
Remarque : le passage de liquide à gaz est appelé liquéfaction notamment lorsque le gaz est comprimé pour passer à l'état liquide, lorsque ce passage est du à un abaissement de température, on parle aussi de condensation.
Remarque : notion de "zéro absolu"
Il n'y a pas de limite supérieure à la température tant que des particules pourront s'agiter davantage. Mais si on fait le cheminement inverse, il y a une limite au refroidissement : lorsqu'on refroidi un solide, ses particules s'agiteront de moins en moins jusqu'à ce qu'elles ne s'agitent plus du tout. On ne peut alors refroidir davantage, on a atteint la température la plus froide de l'Univers appelée "zéro absolu". Cette température est connue, c'est l'origine de l'échelle de température utilisée par les scientifiques dont l'unité est le degré Kelvin, 0 °K = - 273,15 °C.
- Détails
- Écrit par F Leleu
 En dehors des risques évidents d'incendie ou d'explosion lors d'une combustion à proximité de matières inflammables, il existe des dangers "chimiques" liés à cette réaction :
En dehors des risques évidents d'incendie ou d'explosion lors d'une combustion à proximité de matières inflammables, il existe des dangers "chimiques" liés à cette réaction :
- Une combustion consomme du dioxygène. Elle doit donc être réalisée dans un endroit aéré pour éviter les risques d'asphyxie (de Wikipedia : Arrêt plus ou moins long de la circulation d'oxygène dans un corps. Sans action extérieure, l'asphyxie va rapidement mener à l'inconscience puis à la mort. L'asphyxie de l'humain est une urgence médicale.)
- De plus, lorsque le dioxygène vient à manquer, la combustion des matériaux organiques (bois, charbon, pétrole…) produit du monoxyde de carbone (CO) au lieu de dioxyde de carbone. Ce gaz est incolore, inodore et hautement toxique. Il entraine l'asphyxie en se fixant sur nos globules rouges, cellules chargées du transport du dioxygène dans notre sang (0,2% de ce gaz dans l'air que nous respirons suffisent pour entraîner la mort en une trentaine de minutes).
- La combustion de certains produits organiques (plastiques…) peut dégager d'autres gaz toxiques. (Exemple : la présence de chlore dans le polychlorure de vinyle (PVC : tuyaux, isolation électrique...) produit du chlorure d'hydrogène, gaz qui se dissous dans les muqueuses respiratoires sous forme d'acide chlorhydrique, ça pique !).
Feux d'hydrocarbures (Tout feu ne s'éteint pas forcément avec de l'eau !)
